CLORETOS EM SISTEMAS DE RESFRIAMENTO

QUAL O MELHOR SEQUESTRANTE DE OXIGÊNIO PARA SUA CALDEIRA?
20/01/2021
CORROSÃO EM TUBULAÇÕES DE ÁGUA INDUSTRIAL E/OU POTÁVEL
21/01/2021
QUAL O LIMITE SEGURO PARA CLORETOS? E PARA SISTEMAS COM AÇO INOXIDÁVEL?
Esse é um problema crítico em sistemas de resfriamento, principalmente quando se tem aço inoxidável e que gera muitas dúvidas e preocupações.
Quando existem equipamentos de aço inox 304/316, a concentração máxima de cloretos deve ser aquela especificada pelo fabricante do equipamento. Outra opção, é definir um limite considerando a criticidade e o histórico do sistema. Normalmente, o limite deve ser <300 ppm.
Os íons cloretos e sulfatos elevam significativamente a agressividade da água, com forte tendência à corrosão por pites em aço inox e assim, deve ser especificado um limite para a somatório das concentrações de cloretos (Cl–) e sulfatos (SO4–). A prática tem demonstrado que é possível a operação de sistemas de resfriamento com inibição satisfatória à corrosão por pites com programa de tratamento adequado e limite das concentrações de cloretos + sulfatos < 500 ppm.
Temos um caso real, com inox 304 e 316, operando há mais de 40 anos com teores médios de cloretos e sulfatos no make up de 160 ppm de 80 ppm respectivamente e com ciclo de 4. Assim, temos 640 ppm e 320 ppm com total de 960 ppm sem evidência de corrosão. Outros sistemas operam com >2.000 ppm de cloretos também sem evidências de corrosão. Por lado, sistemas com concentração de cloretos <100 ppm sofreu perda total do trocador de calor com menos de 1 ano de operação.
Se seguirmos a orientação da literatura ou do fabricante, muitas vezes conservador em função de garantias dos equipamentos, teríamos de desativar a fábrica.
ENTÃO QUAL É A SOLUÇÃO?
1- SEMPRE, que possível, seguir a orientação do fabricante do sistema, mas que muitas vezes fornece um equipamento sem verificar a qualidade da água.
2- Outros fatores devem também ser considerados, tais como: make up; temperatura; condutividade; tipo de inox; áreas de soldas ,as principalmente, o HISTÓRICO DO SISTEMA, observando se já houve relatos de corrosão por cloretos; concentração de operação; tipo de tratamento utilizado; monitorar as taxas de corrosão, deposição e de pitting; etc.
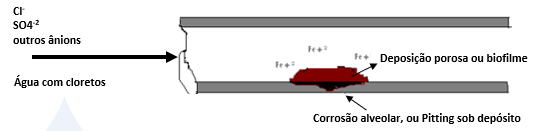
A célula de corrosão em aço inoxidável pode ser ilustrada conforme esquema abaixo:
Reações:
H2O + ½O2 <==> 2Fe2O3 . nH2O
- Feº <==> Fe+² + 2e– (oxidação/anodo)
- H²O + ½O2 + 2e– <==> 2(OH)– (redução/catodo)
Na reação completa: Feº + ½O2 + H2O <==> Fe(OH)2 que reagirá com:
H2O + ½O2 <==> 2Fe(OH)3 que continuará a reação com:
H2O + ½O2 <==> 2Fe2O3 . nH2O
Na deficiência de O2 haverá formação de Fe3O4 (magnetita) e na presença de O2 haverá formação de 3Fe2O3 (hematita) . nH2O.
Na região com menor aeração e com a formação do Fe2O3 . nH²O entre os cristais pode haver uma super pressão equivalente a 4.700 psi, fraturando a liga e concreto, revestimentos, etc..). Este é uma das principais causas de trincas e pode ser ainda mais crítico com a formação de H² e/ou CH4 no interior dos cristais.
Com a oxidação do Fe++ sob o depósito na zona anódica, existe uma grande formação de célula positiva, que provoca um grande fluxo de cargas negativas (Cl–, SO4-2, etc.) visando equilibrar a reação e quando aparece o íon cloreto (Cl–) no interior do depósito, ele será mais eletronegativo que o (OH)–, fazendo com que a reação acima não forme o Fe(OH)2 mas sim o cloreto de ferro II, pois todo cloreto é solúvel e é cíclico, ou seja: forma o cloreto que se hidrolisa e que volta a formar mais cloreto que formará mais ácido e assim por diante, enquanto que o pH sob o depósito será <2, como mostrado nas reações de hidrólise abaixo:
FeCl2 + 2H2O ==> Fe(OH)2 + 2 HCl (pH < 2) ==> Feº + 2HCl ==> FeCl2 + H2 (cíclico), onde este H2 irá migrar também e causando mais danos à liga, como exemplo, a fragilização por hidrogênio,
ou
FeCl3 + 3H2O ==> Fe(OH)2 + 3HCL ou 2FeCl3 + 3H2O ==> Fe2O3 + 6HCl (pH <2)
e a mesma reação para o filme de Cromo:
Cr3Cl3 + 3H2O ==> Cr(OH)3 + 3HCl
A pilha fica cada vez mais positiva com o Fe+², Fe+³ e Cr+³
O O2, por ter solubilidade praticamente nula em soluções muito salinas, não haverá a formação de Fe(OH)2 e sim:
2H+ + 2e- => H2
e este, por sua vez, irá decapar todos os óxidos metálicos de passivação de cada camada (grão) até furar o tubo, ou trincar via a formação do Fe2O3 . n.H20 que tem uma fortíssima pressão em sua formação (isto ocorre mais em menores temperaturas, ao invés da formação do metano que exige altas temperaturas e pressão), conforme a reação abaixo:
Fe3O4 + 8H+ ==> Fe+² + 2Fe+³ + 4H2O
Desta forma, a haverá a decapagem total do filme protetor corroendo todo o ferro sob depósito, da mesma forma para Feº (metálico):
Fe0 + 2H+ ==> Fe+² + H2
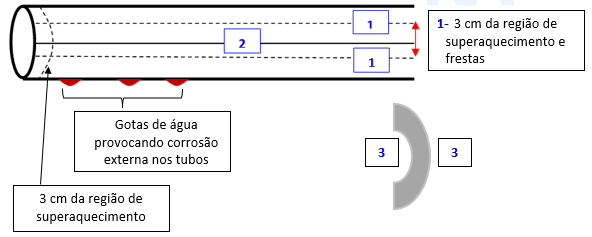
O problema de super aquecimento no aço inox no momento da soldagem dos tubos, pode ocorrer as seguintes consequências:
A reação da formação de 2(OH)– pode ocorrer em meio neutro aerado e não aerado também.
Mas a reação do 2H+ + ½O2 + 2e- ==> H2O em meio ácido aerado e o 2H+ + 2e- ==> H2. Este H+ no estado atômico, poderá formar hidrocarbonetos voláteis, onde o mesmo reage com a cementita (Fe3C (ou carbeto ou carboneto de ferro) formando o gás metano (CH4). Tal formação é brusca e com elevadíssima pressão, causando trincas e empolamentos pelo Hidrogênio na liga, que é mais comum em situações de elevada pressão e temperatura, através da seguinte reação: Fe3C + 2H2 ==> 3 Fe + CH4
FATORES PROVÁVEIS DA CORROSÃO POR CÉLULAS DE CLORETOS EM INÓX:
- DEPOSIÇÃO – Nunca poderá haver a presença de deposição porosa, pois está provado que sob uma pilha como citado acima, a concentração de cloretos poderá chegar à níveis de 4.000 ppm ou mais, independentemente da quantidade de cloretos que se tenha na água de recirculação. A velocidade da reação poderá ser maior ou menor, mas o teor final no longo do tempo será sempre o mesmo para equilibrar sempre as cargas.
- TEMPERATURA – Deverá ser a menor possível. A temperatura próxima à temperatura ambiente seria a ideal e nunca >60 ºC.
- pH – O ideal seria operação com LSI o mais próximo possível de zero na escala de Langelier.
- SOLDAS – Esse fator requer todo cuidado possível, pois poderá ocorrer corrosão severa por pittings nos 3 cm ao redor da linha de soldagem, conforme mostrado no esquema acima.
- PRESENÇA DE FRESTAS – Nas frestas é onde pode acumular sólidos suspensos e consequentemente, onde haverá a formação de pilha de aeração diferencial conforme reações acima.
- ÁREAS DE TENSÕES NA FABRICAÇÃO – As regiões de curvas (3), principalmente onde os cristais estão comprimidos e ou esticados, são muito sensíveis, pois a mínima corrosão poderá provocar trincas.
- TIPO DE AÇO INOX – Deve ser considerado a ação mecânica de velocidade; vibração; concentração de sólidos suspensos na água solução; etc.
Resistência: 304 COM costura << 304 SEM costura << 316 L COM costura << 316 L SEM costura
- TEOR DE CLORETOS – Conforme detalhado anteriormente, o íon cloreto tenderá a ficar sob esses depósitos, se concentrando 10, 20 ou mais vezes sua concentração presente na água de recirculação. Esse é um dos motivos de ser muito difícil se estabelecer um limite seguro de concentração de cloretos em águas, sendo assim, QUANTO MENOR MELHOR.
Compartilhe esse artigo
Se você deseja adquirir nossas apostilas de tratamento de águas de caldeiras e de resfriamento, acesse: www.brunharawater.com.br/contato
Obrigado por acessar nosso site,
Brunhara



